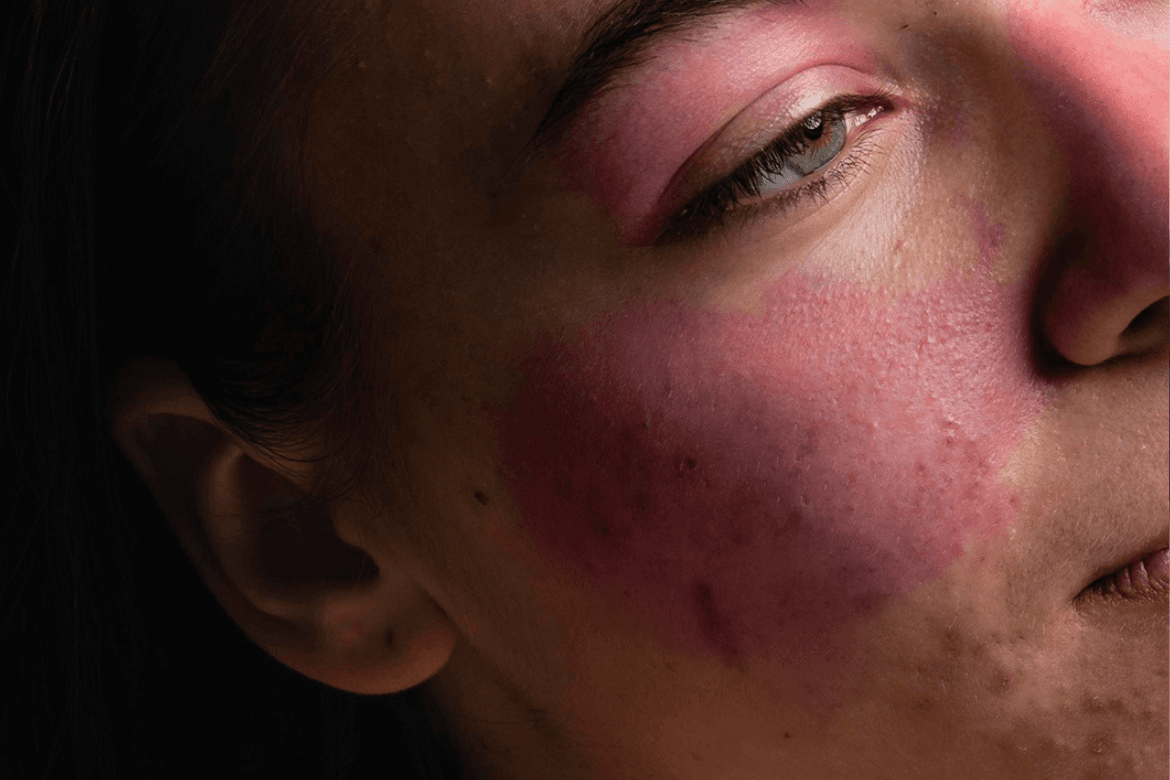La FDA aprobó la investigación clínica en Fase 1 de una nueva molécula para pacientes con nefritis lúpica (LN) y lupus extrarrenal (ERL).
La biotecnología y la investigación médica comenzarán a investigar una nueva molécula que podría ser un cambio significativo en el tratamiento de enfermedades autoinmunes, especialmente el lupus.
La Administración de Alimentos y Medicamentos (FDA) aprobó la investigación clínica de la empresa Caribou Biosciences, líder en edición genética mediante tecnología CRISPR, para el ensayo clínico Fase 1 de su terapia CAR-T alogénica, CB-010, enfocada en pacientes con nefritis lúpica (LN) y lupus extrarrenal (ERL).
La terapia CB-010 es única en su clase, diseñada para atacar las células B CD19 positivas que desempeñan un papel clave en la producción de autoanticuerpos y la progresión de la enfermedad. Este tratamiento incorpora un knockout de PD-1 para reducir el agotamiento de las células CAR-T, aumentando así su eficacia. El estudio clínico, denominado GALLOP, está previsto para comenzar a finales de 2024.
Qué se espera de la molécula
El lupus es una enfermedad autoinmune crónica que puede dañar órganos vitales y causar dolor crónico y fatiga. Actualmente, los tratamientos disponibles ofrecen solo un alivio limitado y pueden tener efectos secundarios significativos. La molécula en estudio CB-010 busca un enfoque innovador que podría proporcionar una remisión sostenida sin medicamentos a largo plazo.
La tecnología CRISPR híbrida de ARN-ADN (chRDNA) de Caribou es altamente precisa y segura, a diferencia de otras terapias que utilizan vectores lentivirales o retrovirales.
El tratamiento CB-010 apunta a eliminar de manera efectiva las células B que causan el lupus. Al ser una terapia alogénica, está disponible “lista para usar”, lo que puede ser crucial para los pacientes que necesitan tratamientos de inmediato.
También te puede interesar: Lupus: por qué es importante hablar de investigación
Los avances del futuro en lupus
El ensayo clínico Fase 1 GALLOP evaluará la seguridad y la eficacia de la molécula CB-010 en pacientes con nefritis lúpica y lupus extrarrenal. El uso de compatibilidad HLA parcial entre donantes y pacientes es una innovación que podría mejorar los resultados y reducir el riesgo de rechazo del tratamiento. Esta estrategia se basa en datos prometedores de otro ensayo, ANTLER, que evaluó el uso de CB-010 en pacientes con linfoma de células B.
El desarrollo de terapias CAR-T alogénicas para el lupus es un avance significativo en el campo de las enfermedades autoinmunes. El tratamiento en investigación podría cambiar radicalmente la forma en que se trata el lupus.
Referencias bibliográficas
Caribou Biosciences Expands Clinical Development of CB-010 with FDA Clearance of IND in Lupus. BERKELEY, Calif., April 04, 2024 https://shorturl.at/amAX0